Daarom gebruiken we de eenheid mol. Een mol is dan simpelweg een hele grote hoeveelheid, bij benadering 6,02 x 10 23 ^{23} 2 3 . Dit getal noemen we ook wel het getal van Avogadro, wat ook wel wordt uitgedrukt met het symbool NA. Als we het hebben over één mol van een stof, dan hebben we het dus over 6,02 x 10 23 ^{23} 2 3.. 1 mol = 6,022 x 10 23 deeltjes. molaire massa = hoeveelheid in gram die 1 mol deeltjes bevat. Voorbeeld: 1 mol ijzer weegt 55,84 gram en bestaat uit 6,022 x 10 23 ijzeratomen. De mol in reacties. We maken het niet moeilijker dan het is: Wat je bij het rekenen nodig hebt: * kloppende reactievergelijking. * molaire massa’s van de reagerende stoffen.

NaSk Volume en massa berekenen met de dichtheid YouTube

Korte uitleg over de mol. Wat is de mol? Hoe reken ik gram om naar mol en mol naar gram. YouTube

De mol scheikunde YouTube
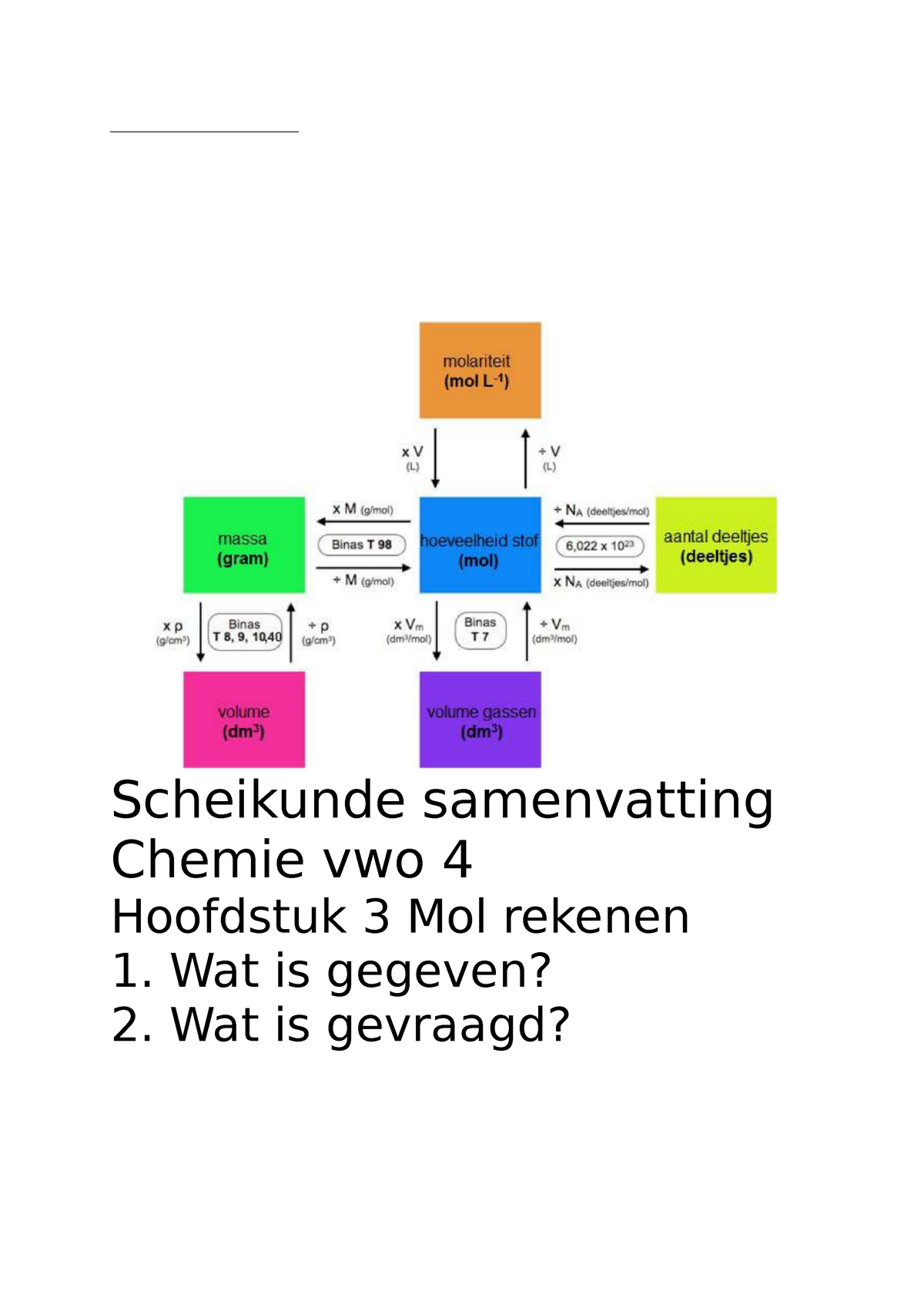
Scheikunde rekentabel Chemie vwo 4 Scheikunde samenvatting Chemie vwo 4 Hoofdstuk 3 Mol

06 De mol chemisch rekenen scheikunde YouTube
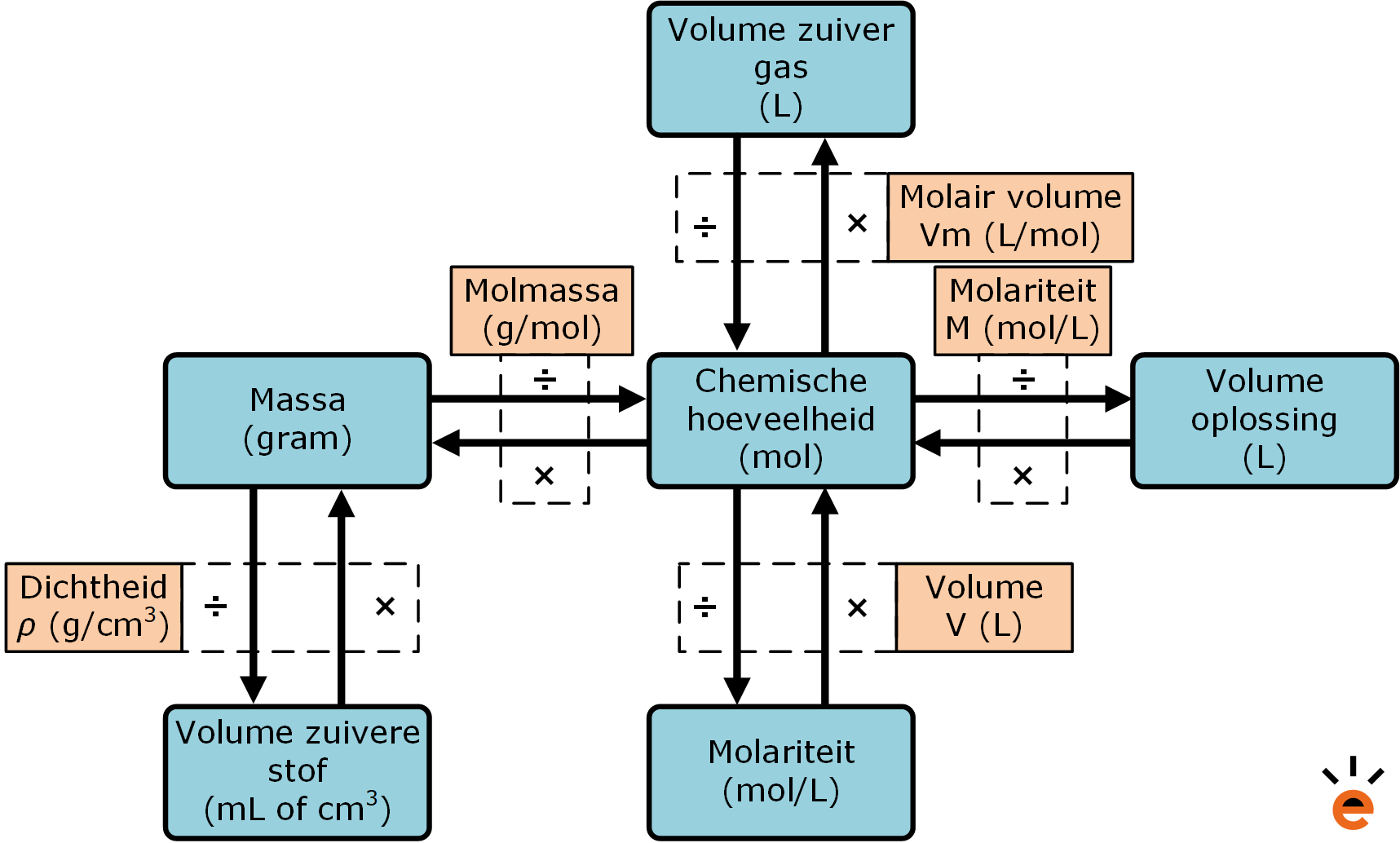
De Mol Wat Is Het en Hoe Reken Je Ermee? (Uitleg)

Scheikunde blokjesschema BètaBijles Online
:max_bytes(150000):strip_icc()/what-is-a-mole-and-why-are-moles-used-602108-FINAL-CS-01-5b7583f6c9e77c00251d4d68.png)
Wat is een mol en waarom wordt het gebruikt in de chemie?

Examen scheikunde Molariteit van oplossingen (Zouten) YouTube

PPT De Mol PowerPoint Presentation, free download ID2756338

SEtraining Scheikunde Examentraining Haarlem

De basis scheikunde WUR

Formules voor scheikunde BètaBijles Online
Aristotle a book on Science

Scheikunde elektrolyse Elektrolyse Inleiding Elektrolyse is een chemische reactie die vaak

Mole Day Avogadro & The Mole Compound Interest
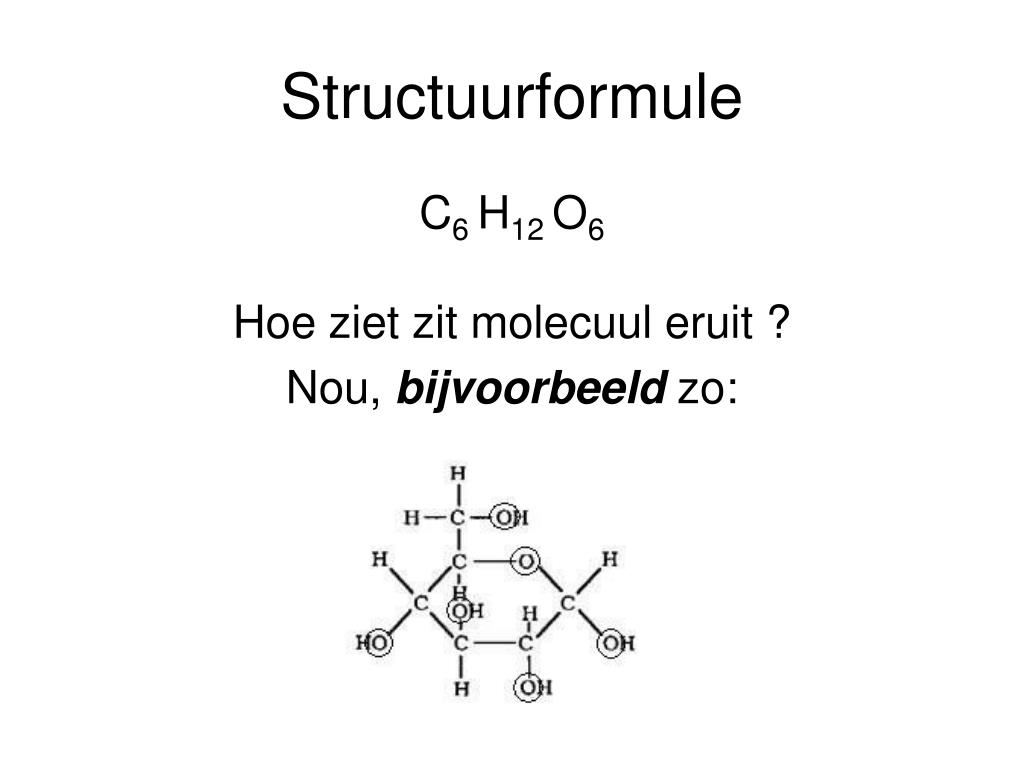
PPT Scheikunde PowerPoint Presentation, free download ID6136099
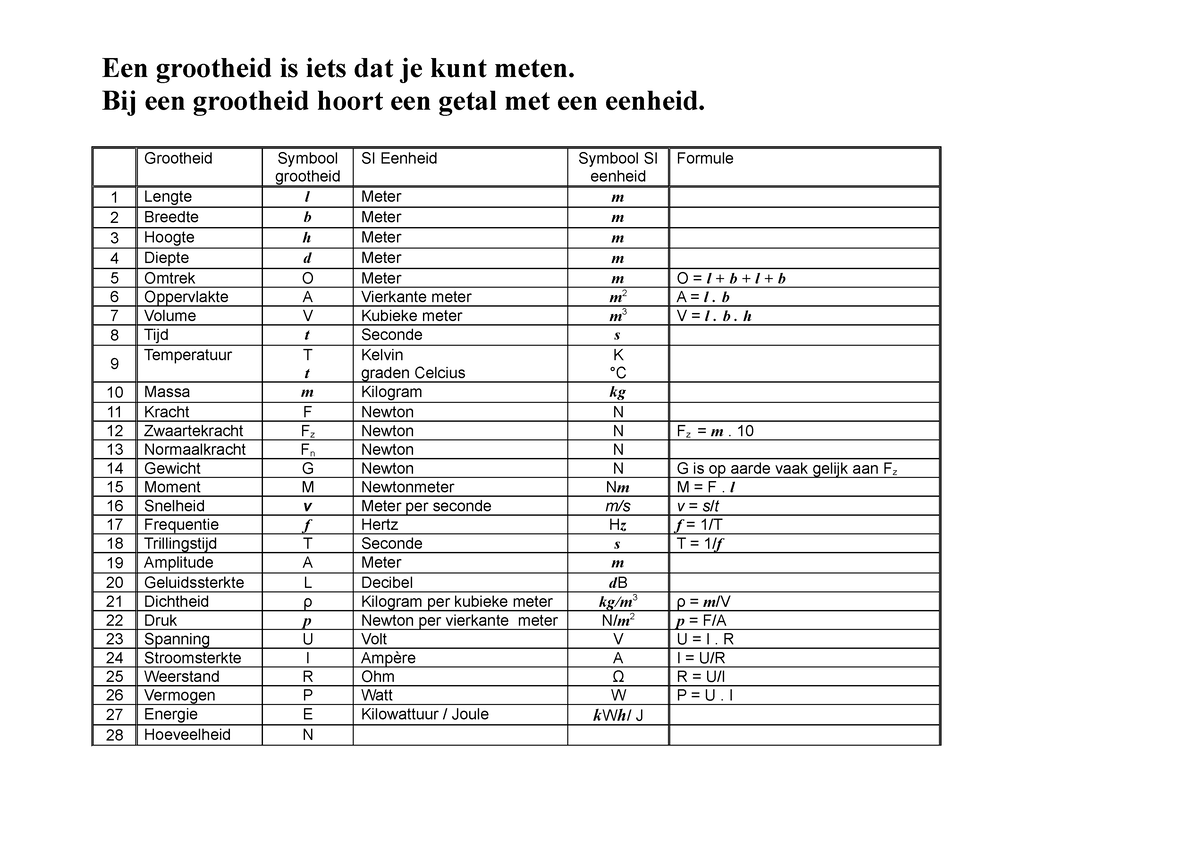
Tabel grootheid eenheden en formules tweede klas 4 Een grootheid is iets dat je kunt meten

vraag wat betekent de letter M in de scheikunde? YouTube
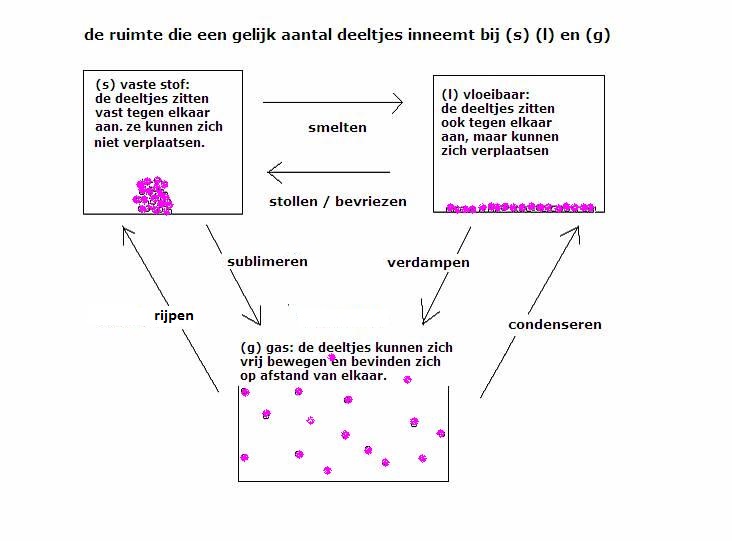
kwantitatieve analyse
Wat m en M betekenen in de scheikunde. Zowel m als M zijn eenheden van de concentratie van een chemische oplossing. De kleine letter m geeft de molaliteit aan, die wordt berekend met behulp van mol opgeloste stof per kilogram oplosmiddel. Een oplossing die deze eenheden gebruikt, wordt een molaire oplossing genoemd (bijv. 0,1 m NaOH is een 0,1 molaire oplossing van natriumhydroxide).. We kunnen van volume naar mol gaan door het volume te vermenigvuldigen met de molariteit. In dit geval wordt dat dan: 5 L x 0,1 mol/L = 0,5 mol zoutzuur. Mol en volume van een gas. Als je het aantal mol van een stof weet en je wil weten wat de massa is, dan gebruik je hiervoor het molair volume (in m3/mol). Dit kun je vinden in tabel 7 in BiNaS.